- 010-68321050
- 搜索
- 企業(yè)郵箱
- 產(chǎn)品定制

專屬客服號

微信訂閱號
全面提升數(shù)據(jù)價值
賦能業(yè)務(wù)提質(zhì)增效
摘要:隨著生物學(xué)和基因?qū)W等各學(xué)科的發(fā)展,近年來生物藥逐漸出現(xiàn)在人們的視野當(dāng)中,由于和其他藥物相比具備明顯臨床優(yōu)勢,因此生物藥成為全球醫(yī)療領(lǐng)域的熱點(diǎn),而隨著生物原研藥專利到期和各國臨床研發(fā)注冊路徑的明確,生物類似藥即將進(jìn)入高速發(fā)展期。
生物藥在臨床治療上有著顯著的優(yōu)勢,其藥理活性高、副作用小、針對性強(qiáng)、療效可靠且營養(yǎng)價值高;在化學(xué)構(gòu)成上,與人體的正常生理機(jī)制高度相關(guān),相對于其他藥物更容易被人體吸收。因此生物制藥工業(yè)從上世紀(jì)70年代開始,被各國政府高度重視且給予大力政策支持,在各國政府的積極推動下,生物藥取得迅猛發(fā)展,成為全球暢銷的藥物產(chǎn)品之一。而受益于生物原研藥專利到期和臨床研發(fā)注冊路徑的明確,生物類似藥在全球范圍內(nèi)進(jìn)入高速發(fā)展期。
原研生物藥核心專利到期是促使類似藥發(fā)展的最大動力
生物類似藥行業(yè)發(fā)展的最大動力來源于原研生物藥的專利到期,據(jù)全球知名醫(yī)療咨詢公司IMS統(tǒng)計(jì),銷售額超過800億美元的生物原研藥在2020年前將會陸續(xù)到期,其中銷售額最大的為阿達(dá)木單抗,2017年全球銷售額為184億美元,原研藥的專利于2018年已到期(歐洲和美國),銷售額超過71億美元的英夫利昔單抗早在2016年到期(歐洲),詳情請見圖1。
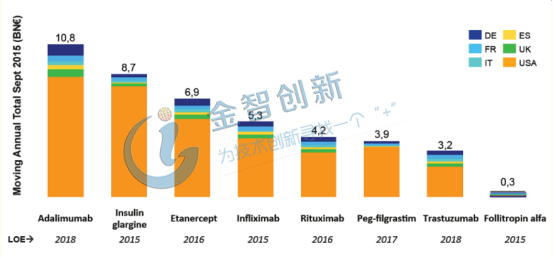
圖1 專利即將到期生物藥全球銷售額
(資料來源:IMS Health)
隨著生物原研藥核心專利的到期,越來越多的生物類似藥在美國和歐洲上市,這里值得提到的是美國對生物原研藥的專利保護(hù)較為嚴(yán)格,美國藥監(jiān)局給生物原研藥的的市場獨(dú)占期長達(dá)12年,而歐洲只有10年;美國的Patent Dance制度中明確規(guī)定了類似藥申請人和原研藥BLA持有人之間的響應(yīng)時間,廠家需要在生物類似藥審批上市的前180天通知BLA持有人。歐洲是全球出臺生物類似藥政策最早的區(qū)域,2005年頒布第一版指導(dǎo)原則,次年批準(zhǔn)第一個生物類似藥,至今已有13年的歷史。所以歐洲和美國類似藥行業(yè)的管理制度等發(fā)展較完善和成熟。
各國政府對生物類似藥注冊的明確是類似藥發(fā)展的第二大驅(qū)動力
促進(jìn)生物類似藥行業(yè)發(fā)展的第二大驅(qū)動力是關(guān)于各國政府對生物類似藥注冊路徑上的突破,其中歐盟是2004出臺的生物類似藥的注冊路徑,屬全球最早并不斷完善;美國次之,2010年出臺了生物制品價格競爭與創(chuàng)新法案-BPCIA,隨后出臺了相應(yīng)的指導(dǎo)方針,并于2014年出臺生物類似藥注冊法規(guī);我國在生物類似藥法規(guī)體系的研究尚屬空白,已于2015年出臺了生物類似藥的注冊征求意見稿,目前注冊法規(guī)仍在不斷完善,預(yù)計(jì)明年將會正式出臺注冊的正式稿。全球生物類似藥注冊路徑的明確可以降低研發(fā)過程中的不確定性,大大縮短研發(fā)時間。圖2為全球生物藥注冊路徑突破情況。

圖2 全球生物藥注冊路徑突破情況
(資料來源:國金證券研究所)
歐盟作為最早出臺生物類似藥注冊路徑的區(qū)域,其先行優(yōu)勢逐步擴(kuò)大,目前歐盟是獲批生物類似藥最多的地區(qū),截止到2017年歐盟共批準(zhǔn)了近40個生物類似藥的文號。
生物藥全球銷售額超2000億美元,生物類似藥將逐步崛起
從全球來看,生物藥2017年銷售額為2280億美金,且保持13%以上的增長,其中美國市場占比超過62%且市場份額在不斷擴(kuò)大,是目前全球生物藥的主要市場;其次歐盟占比為25%;日本份額保持在6-8%左右。
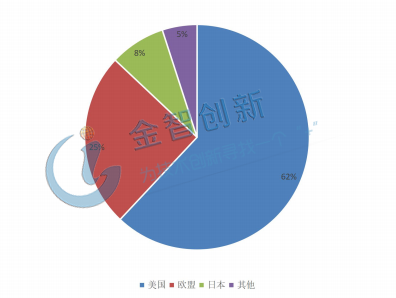
圖3 生物藥各國占比情況
(資料來源:國金證券研究院)
原研藥到期的驅(qū)動,注冊路徑發(fā)生改變的驅(qū)動,引發(fā)全球行業(yè)市場平穩(wěn)增長。2016年銷售額超過15億美金,增速超過45%且保持逐步加速的趨勢,我們認(rèn)為隨著更多重磅產(chǎn)品的專利到期,生物類似藥的銷售額和占比將逐步提高,未來的銷售有望在2020年達(dá)到90億美金,詳情如圖4所示。
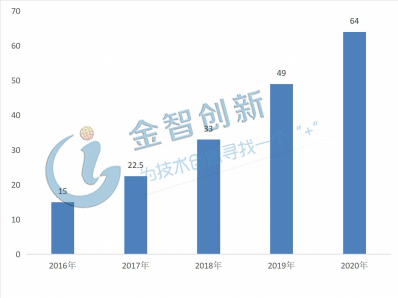
圖4 全球生物類似藥市場規(guī)模情況(單位:億美元)
(資料來源:IMS,五度易鏈行研中心)
據(jù)IMS預(yù)測,隨著專利藥的到期,未來5年,生物類似藥將搶占20%的市場。目前,越來越多的生物類似藥瞄準(zhǔn)了與自身免疫病和腫瘤相關(guān)的大分子藥,尤其是以抗體藥最為火熱。在研生物類似藥的主要分布地區(qū)排名第一的是中國大陸,第二的是印度,第三才是美國。這一方面反應(yīng)了中國有巨大的市場需求,另一方面也反應(yīng)了中國生物類似藥的激烈競爭。
結(jié)語
綜上所述,生物類似藥相比于原研藥而言可以節(jié)省大量的時間和成本,且受益于第一批生物原研藥的專利到期和各國政府對生物類似藥注冊路徑的的明確,生物類似藥即將進(jìn)入高速發(fā)展期,2017年生物藥銷售額超過兩千億美金且高速增長,生物類似藥逐步崛起,隨著重磅產(chǎn)品的專利到期,生物類似藥的銷售額和占比將逐步提高,未來的銷售有望在2020年達(dá)到90億美金。
本文為我公司原創(chuàng),歡迎轉(zhuǎn)載,轉(zhuǎn)載請標(biāo)明出處,違者必究!
請完善以下信息,我們的顧問會在1個工作日內(nèi)與您聯(lián)系,為您安排產(chǎn)品定制服務(wù)
評論