- 010-68321050
- 搜索
- 企業(yè)郵箱
- 產(chǎn)品定制

專屬客服號

微信訂閱號
全面提升數(shù)據(jù)價值
賦能業(yè)務(wù)提質(zhì)增效
1月7日,國家藥監(jiān)局發(fā)布了2020年的1號文《真實世界證據(jù)支持藥物研發(fā)與審評的指導(dǎo)原則(試行)》,旨在厘清藥物研發(fā)和監(jiān)管決策中真實世界證據(jù)的相關(guān)定義,指導(dǎo)真實世界數(shù)據(jù)收集以及適用性評估,為醫(yī)藥界和監(jiān)管部門利用真實世界證據(jù)支持藥物研發(fā)和監(jiān)管決策提供參考意見。
真實世界研究是指針對預(yù)設(shè)的臨床問題,在真實世界環(huán)境下收集與研究對象健康有關(guān)的數(shù)據(jù)(真實世界數(shù)據(jù))或基于這些數(shù)據(jù)衍生的匯總數(shù)據(jù),通過分析,獲得藥物的使用情況及潛在獲益-風(fēng)險的臨床證據(jù)(真實世界證據(jù))的研究過程。當(dāng)前,臨床大數(shù)據(jù)和真實世界研究非常火熱,但實際情況中,卻存在商業(yè)模式不清晰、盈利困難的情況。
隨著一系列改革措施推進(jìn)落實,藥物研發(fā)快速發(fā)展,新藥加速上市,同時對藥物研發(fā)工作的質(zhì)量和效率提出了更高的要求。接下來,我們將探討藥企對于臨床大數(shù)據(jù)的應(yīng)用和變現(xiàn)情況,以及真實世界研究的應(yīng)用場景。
臨床大數(shù)據(jù)與藥物數(shù)據(jù)或健康數(shù)據(jù)不同,臨床數(shù)據(jù)的獲取具有極高的門檻,從這個角度來講數(shù)據(jù)本身就具有較高價值。換句話說,誰擁有了數(shù)據(jù)誰就擁有了發(fā)展臨床數(shù)據(jù)應(yīng)用的絕對主動權(quán)。當(dāng)前臨床大數(shù)據(jù)主要服務(wù)于政府、藥企、醫(yī)院、保險四個類別。這四個類別用戶相對典型,本文僅以討論臨床大數(shù)據(jù)在藥企的應(yīng)用和變現(xiàn)模式。當(dāng)然這四個類別也經(jīng)常聯(lián)動,例如藥企-醫(yī)院,就是一對典型的聯(lián)動體系,臨床大數(shù)據(jù)同時服務(wù)于藥企與醫(yī)院才能構(gòu)成完整的商業(yè)模式。
藥企是臨床大數(shù)據(jù)重要的服務(wù)對象,對于藥企而言無非是兩個方面的應(yīng)用場景。其一是有利于藥品研發(fā);其二是有利于藥品營銷。藥企相對資金比較雄厚,對上述兩個方面有價值的臨床大數(shù)據(jù)產(chǎn)品或服務(wù),企業(yè)則有興趣推進(jìn)。
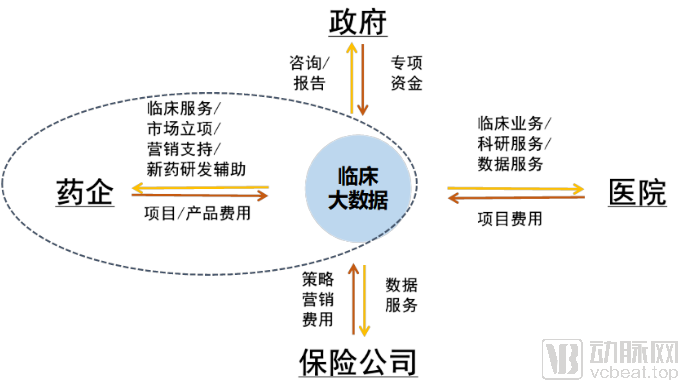
臨床大數(shù)據(jù)的服務(wù)也圍繞著藥品研發(fā)與藥品營銷兩個方面展開。
藥物研發(fā)階段可做的工作很多。首先藥物研發(fā)分為臨床前階段、臨床階段、上市階段。本文只討論臨床大數(shù)據(jù)的應(yīng)用,所以臨床前階段不在討論范圍之內(nèi)。對于臨床階段而言,由于該階段的大量研究屬于前瞻性研究,數(shù)據(jù)需要基于試驗設(shè)計進(jìn)行入組采集分析。在臨床階段,已有的臨床數(shù)據(jù)對于前瞻性研究利用價值有限,但通過已有數(shù)據(jù)尋找患者入組的確是非常有效的。其次,通過臨床數(shù)據(jù)是確定藥物立項的有力證據(jù)。包括是否需要開展新藥研發(fā)立項,是否對新品種進(jìn)行引入(Licence In)等。
藥物營銷階段,臨床數(shù)據(jù)有充分的用武之地,包括藥物上市后評價、真實世界研究、營銷知識圖譜、健康監(jiān)控與隨訪等。例如通過真實世界研究得到某款藥物的有力證據(jù),不但可以公開發(fā)表,甚至可以寫入該藥物的說明書中。這些對于藥企營銷具有莫大的好處。
一、藥物研發(fā)
藥物研發(fā)分為兩個過程,藥物臨床前研究與藥物臨床研究,如下圖所示。對于臨床前研究,主要是處于實驗室階段,臨床數(shù)據(jù)能夠發(fā)揮的余地很小。在新藥臨床階段,主要以前瞻性研究為主,即為了完成一個臨床終點而招募一批患者進(jìn)行入組實驗。在藥物臨床實驗中,所有的數(shù)據(jù)基本都是新產(chǎn)生的,這樣我們已有的臨床數(shù)據(jù)對于新藥臨床實驗本身并沒有太大價值。但是,對于臨床實驗而言,入組人群往往具有較高要求,臨床數(shù)據(jù)可以幫助研究機(jī)構(gòu)尋找合適的入組受試者。

臨床試驗入組
臨床試驗入組有多重方式,當(dāng)前主要的方式有以下幾種:
(1)確保受試者符合倫理已批準(zhǔn)的最新方案所規(guī)定的所有入選標(biāo)準(zhǔn),且不符合任何一項排除標(biāo)準(zhǔn);
(2)招募廣告:可以通過張貼已獲得倫理委員會書面批準(zhǔn)的招募廣告;
(3)對所有就診患者進(jìn)行普遍篩選;
(4)在門診等待合格受試者前來就診;
(5)建立專科、專病門診。
這些方式總體來講是一種招募行為,缺乏精準(zhǔn)性,效率也較低。通過臨床數(shù)據(jù)可以較為精準(zhǔn)的檢索到患者的相關(guān)信息,可以提高招募受試者的效率。但是由于我國電子病歷數(shù)據(jù)互通性很差,區(qū)域內(nèi)很難進(jìn)行電子病歷的融合,在規(guī)范用語方面也很難統(tǒng)一,使得數(shù)據(jù)零散難以檢索。
二、藥物營銷
1.真實世界研究
藥物上市后,最重要的問題就是藥品營銷。藥物上市后臨床研究,以及真實世界研究對藥企的最大利益,就是能夠促進(jìn)該類產(chǎn)品在市場中的地位。所有藥企的研究方向一定是希望獲得自身有利的結(jié)果,如果得到不利證據(jù)也會積極調(diào)整公司策略,盡可能的避免損失。所以從藥企利益的方面考慮,將這部分內(nèi)容放在藥物營銷中進(jìn)行討論。
不過真實世界研究并不是只針對藥物,在醫(yī)療費(fèi)用控制、醫(yī)療質(zhì)量方面也有相應(yīng)的研究路徑。但是為什么當(dāng)前會有這么多與藥品有關(guān)的真實世界研究?
原因很簡單,有商業(yè)模式的研究工作才是一個穩(wěn)定的模式。由于與藥品相關(guān)的研究與藥企商業(yè)利益直接相關(guān),這些研究費(fèi)用會被藥企買單。如此這般,當(dāng)前市場上有關(guān)真實世界研究的項目大多與藥品相關(guān)。
真實世界研究還有一個大方向是醫(yī)療費(fèi)用控制,當(dāng)前醫(yī)保壓力很多,所以國家也在醫(yī)保控費(fèi)方面投入了大量研究金費(fèi)。不過在醫(yī)保控費(fèi)方面,真實世界研究并沒有與商保企業(yè)產(chǎn)生相對明確的商業(yè)模式,所以自然研究的場景沒有藥品豐富。臨床大數(shù)據(jù)與保險有關(guān)的內(nèi)容將在未來的文章中進(jìn)行討論。
所謂真實世界研究,學(xué)術(shù)界有兩種不同的劃分方法。
第一種意見認(rèn)為所有回顧性研究都屬于真實世界研究,簡而言之就是對所有真實醫(yī)療或醫(yī)療周邊產(chǎn)業(yè)產(chǎn)生的數(shù)據(jù)的研究,都屬于真實世界研究。這些數(shù)據(jù)是在診療過程中自然產(chǎn)生的,而不是通過人為設(shè)計某種實驗而得到的。
第二種意見認(rèn)為真實世界研究是所有傳統(tǒng)臨床醫(yī)學(xué)研究之外的部分。傳統(tǒng)醫(yī)學(xué)研究是隨機(jī)對照實驗、隊列研究、病例對照研究、橫斷面研究等教科書里傳統(tǒng)臨床研究類型之外的研究。

針對上述兩個學(xué)術(shù)界的看法,筆者更傾向于第一種看法。在筆者看來,真實世界研究的本質(zhì)是數(shù)據(jù)的來源問題。經(jīng)過嚴(yán)格的實驗對象篩選獲得的數(shù)據(jù)(例如傳統(tǒng)臨床實驗),則不能稱為真實世界研究。只有在非刻意性的基礎(chǔ)上獲得數(shù)據(jù),才能稱為真實世界研究。
所以真實世界研究沒有研究對象的評選標(biāo)準(zhǔn),所有數(shù)據(jù)完全是在現(xiàn)實中產(chǎn)生。在FDA的指南中,對“真實世界數(shù)據(jù)”的定義強(qiáng)調(diào)了兩個點:定期收集(routinely collected),數(shù)據(jù)來源多樣(from a variety of sources)。
(1)優(yōu)效、等效、非劣效研究
藥物療效驗證是藥企最感興趣的項目之一,為了驗證自己的藥物在醫(yī)療環(huán)境中的地位,藥企愿意投入大量資源開展真實世界研究工作。所謂優(yōu)效性試驗是為了驗證藥物是否優(yōu)于另外一種藥物;等效性試驗,即檢驗一種藥物是否與另一種藥物具有相同的療效;非劣效試驗,即驗證一種藥物不差于另外一種。
藥物優(yōu)效、等效、非劣效研究屬于傳統(tǒng)研究范疇,可以通過試驗設(shè)計進(jìn)行試驗。不過從本質(zhì)上而言,該實驗更適用于真實世界研究。只有在實際診療中產(chǎn)生的數(shù)據(jù)才能較好的做出客觀評價。
通常來講,進(jìn)行該類試驗應(yīng)該選取一款市場上廣泛認(rèn)可的藥物作為陽性對照藥,通過與該藥物的對比,得到優(yōu)效、等效、非劣效的相關(guān)結(jié)果。由于被選中陽性對照的藥品,通常都是較強(qiáng)的競爭對手,所有企業(yè)自然希望得到優(yōu)效的結(jié)果。
對于優(yōu)效性試驗而言,其假設(shè)檢驗為:
原假設(shè)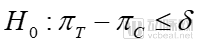
備擇假設(shè)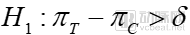
其中δ是一個臨床具有意義的數(shù)值,稱為優(yōu)效性界值。πT為測試藥物的總體有效率,πC為對照藥物的總體有效率。優(yōu)效性的主要目的就是需要確定測試藥物療效需要超過對照藥物的優(yōu)效性界值,且不能低于0點。
對于等效性試驗而言,其假設(shè)檢驗為:
原假設(shè)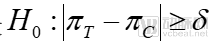
備擇假設(shè)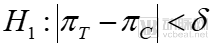
公式中的相關(guān)指標(biāo)與前文中的一致。在等效性實驗中,需要測試藥物與對照藥物的有效性在一個界值中間,即可從統(tǒng)計學(xué)上判斷兩者的等效性。等效性更多的用于仿制藥與原研藥物的一致性評價中。
對于非劣效試驗而言,其假設(shè)檢驗為:
原假設(shè)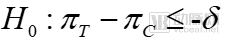
備擇假設(shè)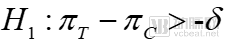
非劣效實驗重點在于確定測試藥物與對照藥物的療效之差不低于下屆,單側(cè)檢驗就可以確定非劣效。下圖很形象的說明了三種實驗的關(guān)系。如果測試藥物的療效低于對照藥物療效的下線界值,那么則無法得出結(jié)論。
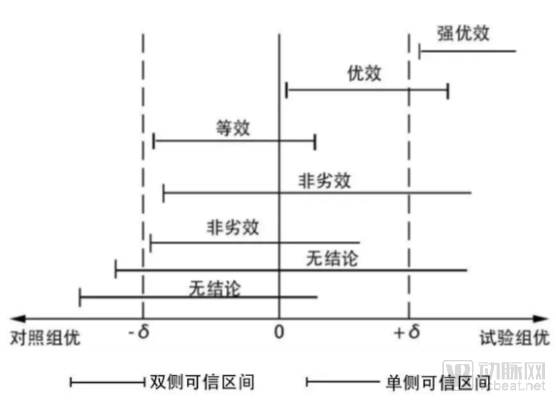
在傳統(tǒng)的生物統(tǒng)計中,以上三種試驗可以通過人為設(shè)計、招募受試者等方式完成。對于真實世界研究,我們需要完全采用真實產(chǎn)生的數(shù)據(jù)而并非利用人為設(shè)計試驗數(shù)據(jù)。
完成以上工作有兩個難點:第一是如何選擇數(shù)據(jù),第二是如何制定臨床指標(biāo)δ。
首先討論如第二個問題,定臨床指標(biāo)δ從來都是一個難題,選大了會使得區(qū)間變大使得測試藥物優(yōu)效性可能降低,或達(dá)不到等效的藥物被判定為等效;如果δ選的較小,則會增加相反概率發(fā)生的可能性。具體情況還需要針對藥物適應(yīng)癥因素確定。常用的指標(biāo)有生化指標(biāo)、生物等效性(EB)等。
第一個問題是如何選擇數(shù)據(jù),這對于真實世界研究非常重要。選擇數(shù)據(jù)有兩種情況,一種是針對于已有的醫(yī)療數(shù)據(jù)進(jìn)行回顧性研究,另一種情況通過對服用兩種藥物的人群進(jìn)行隨訪獲得數(shù)據(jù),屬于一種前瞻性的研究。
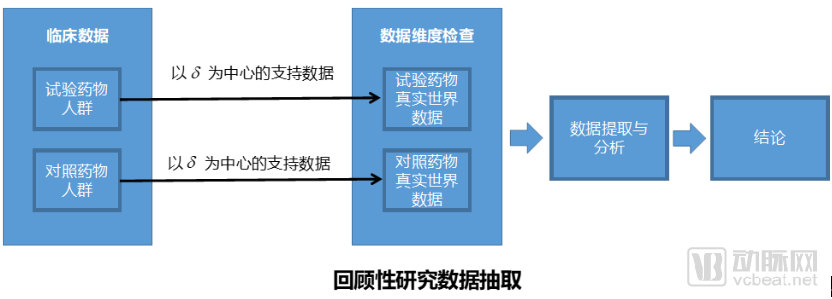
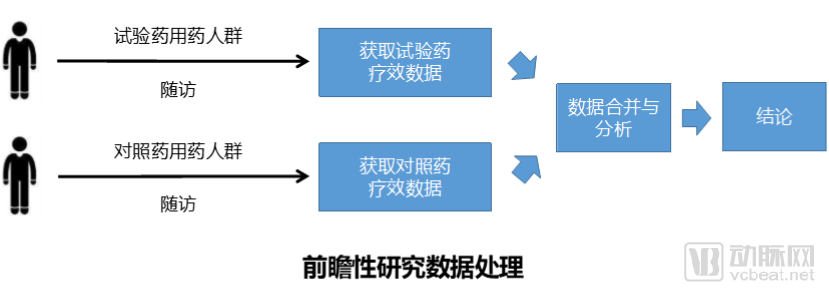
從藥企角度出發(fā),通常希望快速得到相應(yīng)的結(jié)論,不但可以解決成本,對藥品營銷推廣也有好處。回顧性研究的問題在于臨床數(shù)據(jù)是已經(jīng)產(chǎn)生的數(shù)據(jù),這些數(shù)據(jù)質(zhì)量較差并且獲得困難,并不一定能夠達(dá)到對應(yīng)的試驗?zāi)康摹G罢靶匝芯康膯栴}在于隨訪時間周期長,花費(fèi)成本巨大,藥企很難長時間支持這樣一個只投入無結(jié)論的項目。
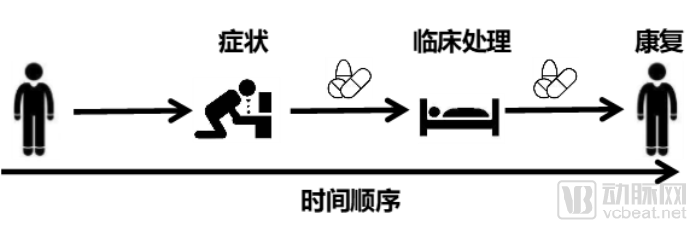
當(dāng)前臨床數(shù)據(jù)遇到最大挑戰(zhàn)是數(shù)據(jù)轉(zhuǎn)換(ETL)及合并,也可以說是數(shù)據(jù)治理的內(nèi)容。在回顧性的真實世界研究中,什么樣的臨床數(shù)據(jù)才是有價值的,我們給出三條建議:
1.明確臨床事件的發(fā)生順序;
2.明確患者身份標(biāo)識;
3.使用統(tǒng)一的編碼規(guī)范。
明確臨床事件的順序在于確定患者的病程及處理情況,大量臨床數(shù)據(jù)無法得到應(yīng)用的原因在于無法看到一個患者,在一段時間內(nèi)的臨床處置及相應(yīng)的結(jié)果。臨床數(shù)據(jù)應(yīng)用,并不一定要求在同一時間段內(nèi)的患者,但需要明確順序因素與時間間隔。
明確患者身份標(biāo)識,這一點很好理解。我們做真實世界研究大多數(shù)以患者為單位進(jìn)行,即使研究某個藥物或療法,也需要根據(jù)患者個體進(jìn)行分析。
使用統(tǒng)一的臨床編碼規(guī)范,這是醫(yī)療大數(shù)據(jù)應(yīng)用中老生常談的問題。在這里不進(jìn)行過多的討論,希望各家醫(yī)院能夠盡量遵守。上述三個基本要求如圖所示。
對于真實世界的研究結(jié)論,良好的結(jié)論藥企可以寫入自己的說明書中,不利的結(jié)論企業(yè)應(yīng)該立刻調(diào)整自己的市場布局,躲避不利因素。
(2)藥物不良反應(yīng)監(jiān)測與藥物警戒
藥物不良反應(yīng)監(jiān)測更多的是一種責(zé)任與義務(wù)。在國外很多不良反應(yīng)監(jiān)測工作由藥企完成,在國內(nèi)更多的是由政府及相關(guān)部門進(jìn)行監(jiān)控。
藥物不不良反應(yīng)監(jiān)測更多的是一種企業(yè)責(zé)任,特別是在新藥上市之后,可以通過不良反應(yīng)監(jiān)測根據(jù)完善藥品說明書,讓用藥更加安全。從藥企利益的角度考慮,藥企更應(yīng)該主動進(jìn)行藥物不良反應(yīng)監(jiān)測,以降低由于不良反應(yīng)而產(chǎn)生的高昂賠償費(fèi)用。
藥物不良反應(yīng)的發(fā)生機(jī)理是比較復(fù)雜的,歸納可分為甲型和乙型兩大類。
前者是由于藥物的藥理作用增強(qiáng)所致,其特點是可以預(yù)測,一般與藥物劑量有關(guān),其在人群中的發(fā)生率雖高,但死亡率低。后者與正常藥理作用完全無關(guān)的一種異常反應(yīng),通常很難預(yù)測,常規(guī)毒理學(xué)篩選不能發(fā)現(xiàn)。
常用的流行病評價方法同樣也有回顧性研究與前瞻性研究兩種,這兩者分別對應(yīng)了病例對照研究與隊列研究。前者是已知發(fā)生了某不良反應(yīng)后,追查由某藥物引起的可能性大小;后者是對研究對象追蹤隨訪一段時間,比較暴露于藥物的研究對象中不良反應(yīng)的發(fā)生率是否較不暴露于藥物的研究對象更高。藥物不良反應(yīng)往往從真實世界數(shù)據(jù)中發(fā)現(xiàn),通過傳統(tǒng)臨床試驗等方法確認(rèn)。
藥物不良反應(yīng)與藥物警戒在全球已經(jīng)研究了很多年,不僅提出了多種算法,數(shù)據(jù)分析種類也由醫(yī)療數(shù)據(jù)分析轉(zhuǎn)向醫(yī)療數(shù)據(jù)、社交數(shù)據(jù)共同分析的方法。當(dāng)前大數(shù)據(jù)、機(jī)器學(xué)習(xí)等多種算法都應(yīng)用于藥物不良反應(yīng)信號的發(fā)現(xiàn)。在藥物不良反應(yīng)與藥物警戒中,有兩項核心工作:藥物不良反應(yīng)數(shù)據(jù)庫構(gòu)建和不良反應(yīng)數(shù)據(jù)挖掘。
藥物不良反應(yīng)數(shù)據(jù)庫是一個多數(shù)據(jù)源的數(shù)據(jù)庫,也就是說并不只來源于臨床中產(chǎn)生的數(shù)據(jù),還包括蛋白、靶點等藥物數(shù)據(jù)。當(dāng)前的不良反應(yīng)數(shù)據(jù)大多數(shù)以不良反應(yīng)上報為主,在未來的發(fā)展中,可以借助人工智能等技術(shù)手段構(gòu)建疑似不良反應(yīng)數(shù)據(jù)庫。該數(shù)據(jù)庫直接來自于臨床過程產(chǎn)生的數(shù)據(jù),將一些臨床癥狀與用藥情況疊加進(jìn)行判定,主動挖掘一些不良反應(yīng)事件。
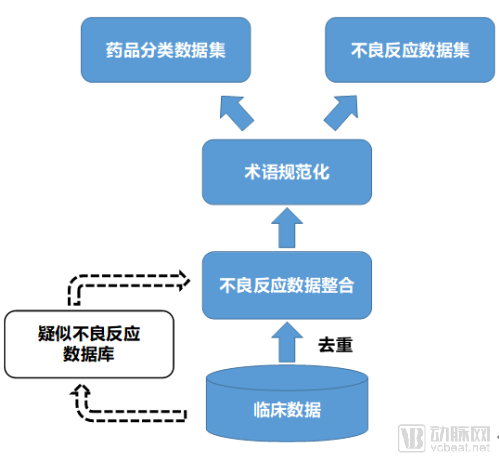
藥物不良反應(yīng)算法方面研究也同樣非常深入。主要分為三個大類:比例失衡分析算法(DPA)、邏輯回歸算法(LRM)、關(guān)聯(lián)規(guī)則挖掘算法(ARM)。
在AI與機(jī)器學(xué)習(xí)發(fā)展的今天,決策樹、聚類、神經(jīng)網(wǎng)絡(luò)等算法都會用作藥物不良反應(yīng)的挖掘工作。具體的算法內(nèi)容本文不進(jìn)行細(xì)節(jié)展開。
探索藥物不良的試驗方法有四種:差異法、協(xié)同法、共變法、類比法。這四種方法也可以作為臨床數(shù)據(jù)研究的理論依據(jù)。
差異法就是從相同中尋找不同的因素,這種不同的因素就有可能是引起醫(yī)學(xué)事件的原因。例如有一人群患有心律失常,當(dāng)應(yīng)用傳統(tǒng)的抗心律失常藥物無效時,停藥后又改用胺碘酮,結(jié)果有部分患者不僅原有的心律失常未得到控制,卻又發(fā)生了扭轉(zhuǎn)性室速。同屬一組人群,在使用胺碘酮前和后可找出的不同因素正是胺碘酮,因此,可以假設(shè)胺碘酮會引起扭轉(zhuǎn)性室速。據(jù)此,便可再作進(jìn)一步的分析性研究。
協(xié)同法適用于在不同的時間、不同的空間或不同人口統(tǒng)計學(xué)的人群中的某些人出現(xiàn)了同一種醫(yī)學(xué)事件,就可以采用這一方法提出假設(shè)。例如調(diào)查食物中毒就可以使用這種方法。
共變法適用于某種醫(yī)學(xué)事件的發(fā)生頻率,隨著某種客觀因素的數(shù)量變動成正比地相應(yīng)變動,這種數(shù)量變動的客觀因素就可能是引起醫(yī)學(xué)事件的原因。轟動全世界的“反應(yīng)停事件”就是通過這一方法提出假設(shè)的,研究者們巧妙地將相關(guān)年代反應(yīng)停的市場銷售信息與醫(yī)學(xué)事件聯(lián)系起來,繪出一個銷售總量與病例數(shù)的時間分布曲線圖。
類比法是把原因不明的醫(yī)學(xué)事件和另一已十分清楚的客觀因素進(jìn)行比較,如有相似之處,說明這種客觀因素可能就是引起醫(yī)學(xué)事件的原因。例如瑞氏綜合征(Reye’s syndrome)的研究中,有人發(fā)現(xiàn)水楊酸中毒的臨床和組織學(xué)改變很類似該綜合征,于是通過邏輯推理提出了假設(shè)。
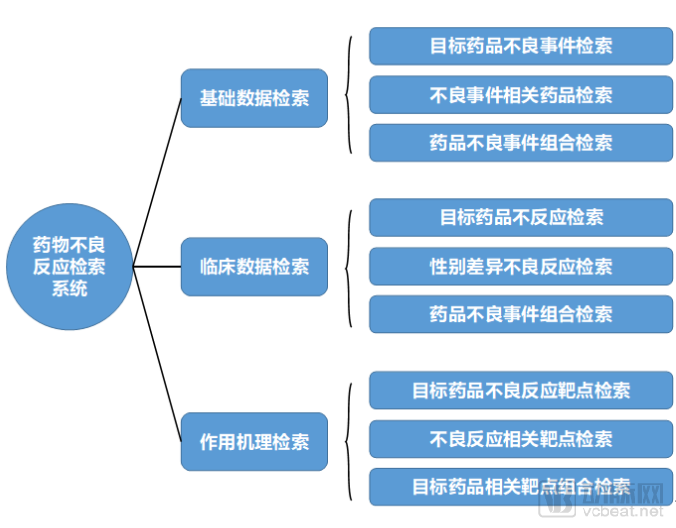
藥企可以借助臨床數(shù)據(jù)對藥物不良反應(yīng)進(jìn)行主動性研究。首先確定使用本公司某種藥物的相關(guān)人群。對于人群中發(fā)生的任何相關(guān)的臨床現(xiàn)象進(jìn)行聚類,按照診療的事件數(shù)據(jù)進(jìn)行分。藥物不良反應(yīng)的研究成果,一般以平臺或系統(tǒng)形式呈現(xiàn)。該平臺可以進(jìn)行不良事件檢索、不良事件相關(guān)藥物檢索以及相關(guān)的不良事件組合檢索。
2.藥物情報知識圖譜
藥物營銷之前依靠醫(yī)藥代表,現(xiàn)在各個醫(yī)院對醫(yī)藥代表管理嚴(yán)格,各大藥企的藥物推廣更多的變更為專家型營銷方式,通過對醫(yī)生、患者的教育,使他們了解自己公司的產(chǎn)品,以知識的方式傳遞營銷思路。現(xiàn)在的醫(yī)藥代表往往會手持一個pad,里面有藥物的所有資料以及相關(guān)的臨床證據(jù),甚至是一些醫(yī)藥有關(guān)的問答系統(tǒng)。這樣一個醫(yī)藥知識的檢索平臺或者說問答系統(tǒng)就可以利用知識圖譜技術(shù)進(jìn)行構(gòu)建。
針對藥企而言,在營銷方面醫(yī)療知識圖譜可以說是一個最直接的應(yīng)用,針對藥物臨床、臨床前的學(xué)術(shù)檢索,也是知識圖譜的一大應(yīng)用場景。
醫(yī)學(xué)知識圖譜構(gòu)建技術(shù)歸納為五部分,即醫(yī)學(xué)知識的表示、抽取、融合、推理以及質(zhì)量評估。通過從大量的結(jié)構(gòu)化或非結(jié)構(gòu)化的醫(yī)學(xué)數(shù)據(jù)中提取出實體、關(guān)系、屬性等知識圖譜的組成元素,選擇合理高效的方式存入知識庫。醫(yī)學(xué)知識融合對醫(yī)學(xué)知識庫內(nèi)容進(jìn)行消歧和鏈接,增強(qiáng)知識庫內(nèi)部的邏輯性和表達(dá)能力,并通過人工或自動的方式為醫(yī)學(xué)知識圖譜更新舊知識或補(bǔ)充新知識。
知識圖譜的數(shù)據(jù)來源非常多樣,臨床大數(shù)據(jù)只是知識圖譜數(shù)據(jù)來源的一個方面,下圖就表現(xiàn)了知識圖譜數(shù)據(jù)來源的多樣性。

從變現(xiàn)方面來講,知識圖譜更多的是以知識庫的形式提供服務(wù),當(dāng)然可以擴(kuò)展為問答機(jī)器人等業(yè)務(wù)應(yīng)用。知識圖譜在企業(yè)內(nèi)部可以提高藥企的營銷水平,協(xié)助營銷人員更好的推介產(chǎn)品。知識圖譜對外是一套知識庫體系,可以通過售賣賬號獲取年費(fèi)進(jìn)行變現(xiàn)。
這篇文章主要針對于藥企討論臨床大數(shù)據(jù)的應(yīng)用與變現(xiàn)情況。對藥企而言,它不同于醫(yī)院,企業(yè)的最終目的是盈利,所以,藥企必將參與到其商業(yè)模式中。藥企對于臨床大數(shù)據(jù)的應(yīng)用可以說是一個正向的推動力,只有具備商業(yè)利益的模式才是一種穩(wěn)定的模式,也會將臨床數(shù)據(jù)應(yīng)用推向新的高度。
作者:高飛(筆名:白白)
資深產(chǎn)品專家。擁有數(shù)學(xué)、計算機(jī)、藥學(xué)交叉學(xué)科背景。在大數(shù)據(jù)與人工智能領(lǐng)域?qū)W⒂谛袠I(yè)與技術(shù)的結(jié)合,擁有超過7年的AI算法與產(chǎn)品經(jīng)驗,對產(chǎn)業(yè)互聯(lián)網(wǎng)的相關(guān)業(yè)務(wù)與商業(yè)模式具有深度研究。
曾任職于中國科學(xué)院化學(xué)研究所及Pharmaron藥物公司從事小分子藥物研發(fā)工作,高級科學(xué)家(Senior Scientist)。2014年開始從事AI算法研究及產(chǎn)品研發(fā)工作,主持研發(fā)了國內(nèi)首個藥物臨床前智能數(shù)據(jù)平臺,得到國家新藥評審中心(CDE)高度認(rèn)可。多次主持研發(fā)了區(qū)域電子病歷及健康檔案大數(shù)據(jù)平臺,服務(wù)于江西、山東等省份。曾應(yīng)邀主持國際頂級雜志科學(xué)(Science)中國年會,醫(yī)療與腦科學(xué)分會。曾應(yīng)邀參與協(xié)和醫(yī)院“協(xié)和百年”信息規(guī)劃項目,提供臨床科研智能平臺設(shè)計方案。
現(xiàn)任國家慢病防控信息技術(shù)委員會理事,中國藥學(xué)會高級會員,中國衛(wèi)生信息協(xié)會常務(wù)理事
來源:動脈網(wǎng)
本文為本網(wǎng)轉(zhuǎn)載,出于傳遞更多信息之目的,并不意味著贊同其觀點或證實其內(nèi)容的真實性,如涉及侵權(quán),請權(quán)利人與本站聯(lián)系,本站經(jīng)核實后予以修改或刪除。
請完善以下信息,我們的顧問會在1個工作日內(nèi)與您聯(lián)系,為您安排產(chǎn)品定制服務(wù)
評論